Vihreä fluoresoiva proteiini
Vihreä fluoresoiva proteiini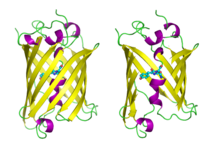 Vihreä fluoresoiva proteiini, joka näkyy kokonaisena vasemmalla ja oikealla auki kromoforin osoittamiseksi ( PDB 1GFL )
Vihreä fluoresoiva proteiini, joka näkyy kokonaisena vasemmalla ja oikealla auki kromoforin osoittamiseksi ( PDB 1GFL )
| Pfam | PF01353 |
|---|---|
| Pfam- klaani | CL0069 |
| InterPro | IPR011584 |
| SCOP | 1 |
| SUPERFAMILY | 1 |
Vihreä fluoresoiva proteiini (usein lyhennetty GFP , Englanti " vihreä fluoresoiva proteiini ") on proteiini, jolla on se ominaisuus säteilee fluoresenssi väri vihreä . Johdettu meduusa ( Aequorea victoria ), tämä proteiini on luontaisesti fluoresoiva vaikutuksesta entsyymin, aequorein, joka on lusiferaasi , joka toimii kalsiumin läsnä ollessa. Sen geeni voidaan fuusioida in vitro proteiinin geenin kanssa, jota halutaan tutkia. Rekombinanttigeeni sitten uudelleen sisään solut tai alkion , joka sitten tiivistetään fuusioproteiini , joka on sitten fluoresoiva. Sitten se voidaan havaita esimerkiksi fluoresenssimikroskoopilla . Tämä menetelmä mahdollistaa proteiinien tutkimisen niiden luonnollisessa ympäristössä: elävässä solussa. Löytö ja sovellukset PFM kruunattiin kanssa Nobelin kemian myönnetty Osamu Shimomura , Martin Chalfie ja Roger Tsien8. lokakuuta 2008.
Rakenne
GFP kuvattiin ensimmäisen kerran vuonna 1962 . Se koostuu 238 aminohaposta, joiden molekyylipaino on noin 27 kDa. Kromofori (aktiivinen keskus vastaa fluoresenssin) koostuu sivuketjujen on glysiini , joka on tyrosiini- ja seriini .
Modifioimattomalla GFP: llä, jota kutsutaan villityypiksi ( villityyppi GFP , wGFP), on kaksi viritysmaximaalia. Ensimmäisen aallonpituus on 395 nm (UV-valo), toisen aallonpituus 475 nm (sininen valo). Suurin emissioaallonpituus on 504 nm . Se on myös valoherkkä, mikä tarkoittaa, että säteilevän fluoresenssin voimakkuutta tehostaa altistuminen ultraviolettifotoneille, ominaisuus menetetään useimmissa myöhemmin tuotetuissa muunnoksissa.
GFP: stä on nyt olemassa erilaisia muunnelmia, jotka on saatu muokkaamalla sitä geenitekniikan avulla. On myös muita fluoresoivia proteiineja muista organismeista kuin A.Victoria :
- EGFP: vihreä fluoresenssi ( parannettu GFP );
- CFP : syaanifluoresenssi (sinivihreä) ja sen muunnos Cerulean;
- E YFP : keltainen fluoresenssi (Y keltaiselle ) ja sen variantit Venus ja Citrine;
- E BFP : sininen fluoresenssi ja sen muunnos atsuriitti:
- PA-GFP: GFP-valolla aktivoitava 405 nm : ssä:
- PHluoriini: pH-herkkä GFP, sammuu happamassa pH: ssa.
On osoitettu, että proteiiniin fuusioitunut GFP voi auttaa sen taittumista geeniekspressionsa aikana .
Muut fluoresoivat proteiinit
- DsRed : Discosoma-suvun punainen fluoresenssi korallista . Se on oranssinpunaisen alueen toisen varianttiperheen alku.
- Keima : punainen fluoresenssi sinisellä virityksellä ( suuri Stokes-muutos )
Käyttö biologian tutkimuksessa
Periaate
Vihreää fluoresoivaa proteiinia voidaan käyttää reportterigeeninä . Liittyy geeni, se mahdollistaa suoran havainnoinnin ilmentymisen tämän geenin solussa in fluoresenssimikroskoopilla . GFP-proteiinia koodaava geeni sisällytetään organismin genomiin geenin alueelle, joka koodaa mielenkiintoista proteiinia ja jota siten kontrolloidaan samalla säätelysekvenssillä. Soluissa, joissa geeni ilmentyy ja kiinnostava proteiini tuotetaan, GFP syntetisoidaan samanaikaisesti. Siten näistä soluista tulee fluoresoivia, kun taas ne, jotka eivät ilmentää kiinnostavaa geeniä, pysyvät inertteinä fluoresenssimikroskopian valossa .
Edut
GFP: n havaitseminen ei ole invasiivista: se voidaan havaita suoraan valaisemalla näyte tietyn aallonpituisella valolla. Lisäksi GFP on suhteellisen pieni ja inertti molekyyli, joka ei näytä olevan vuorovaikutuksessa minkään kiinnostavan biologisen prosessin kanssa. Koska GFP on monomeeri , se voi diffundoitua nopeasti solujen läpi. Ennen GFP: tä käytetyt reportterigeenit, kuten beeta-galaktosidaasi, sisälsivät organismin tai solujen 'kiinnittämisen' (tappamisen) siten, että niitä voitiin havaita, kun taas GFP kerääntyy eläviin soluihin reaaliajassa, mikä sallii havaita ilmentymisen muutoksia koe. Lisäksi se mahdollistaa näytteen yksilöiden (solujen) vaihtelun mittaamisen. Lopuksi, PFM on perinnöllinen.
Fluoresenssimikroskopia
GFP: n ja siitä johdettujen proteiinien löytäminen on muuttanut perusteellisesti fluoresenssimikroskopiaa ja sen käyttöä solubiologiassa. Vaikka useimmat pienet fluoresoivat molekyylit, kuten fluoreseiini, ovat erittäin myrkyllisiä käytettäessä elävissä soluissa, fluoresoivat proteiinit, kuten GFP, ovat paljon vähemmän vaarallisia näytteessä valaistuina. Tämä on käynnistänyt automatisoitujen järjestelmien kehittämisen muiden proteiinien ilmentymisen seuraamiseksi, joiden geenit on liitetty GFP: n tai muiden vastaavien proteiinien ilmentymiseen. Tätä tekniikkaa voidaan käyttää in vitro tai in vivo .
Sovellukset
GFP-siirtogeenisten rottien uusia linjoja käytetään tutkimuksiin geeniterapiassa sekä regeneratiivisessa lääketieteessä. Tämä johtuu siitä, että useimmat reportterigeenillä leimatut solut aiheuttavat immuunivasteen, kun ne viedään isäntään. Rotan linjat, jotka ilmentävät GFP: tä korkealla tasolla kaikissa soluissaan, voivat toimia solujen lähteenä toisiin isäntiin, mikä ei todennäköisesti aiheuta hylkäämistä. GFP: tä käytetään myös laajalti syöpätutkimuksessa syöpäsolujen merkitsemiseen ja jäljittämiseen. Näitä soluja on käytetty metastaasin mallintamiseen, prosessiin, jolla syöpäsolut leviävät muihin elimiin.
PFM kuvataiteessa
Julian Voss-Andreae , saksalaissyntyinen taiteilija, joka on erikoistunut '' proteiiniveistoksiin '', teki veistoksia GFP-rakenteen pohjalta, mukaan lukien 1,70 metriä pitkä veistos nimeltään Vihreä fluoresoiva proteiini (2004) ja Teräsmeduusaveistos (2006), korkeus 1,40 metriä. . Jälkimmäinen asennetaan Washington Harbor -yliopiston Friday Harbour -laboratorioihin , joissa Shimomura löysi GFP: n vuonna 1962.
Eduardo Kac , taiteilija, joka käyttää PFM: ää BioArt-teoksissaan.
Katso myös
Aiheeseen liittyvät artikkelit
- GloFish , seeprikalan rekisteröity tavaramerkki, jota on muunnettu geneettisesti lisäämällä sen genomiin fluoresoivan proteiinin geeni, joka antaa punaisen, vihreän ja vaaleanoranssin värin.
- Amerikkalainen biologi Tulle Hazelrigg kiinnitti ensimmäisenä vihreän fluoresoivan proteiinin muihin proteiineihin.
Ulkoiset linkit
Huomautuksia ja viitteitä
- Kemia: Nobel fluoresoivaksi meduusoja vuonna Liberation 8. lokakuuta, 2008.
- Kemian Nobel-palkinto 2008: fluoresoiva meduusa palkittiin . Artikkeli École normale supérieure - DGESCO.
- Chalfie M, " GFP: Lighting up life ", Proceedings of the National Academy of Sciences of the United States of America , voi. 106, n ° 25,Kesäkuu 2009, s. 10073-10080 ( PMID 19553219 , DOI 10.1073 / pnas.0904061106 ).
- Mark R. Soboleski, Jason Oaks ja William P. Halford, " Vihreä fluoresoiva proteiini on kvantitatiivinen reportteri geeniekspressiosta yksittäisissä eukaryoottisoluissa ", The FASEB Journal , voi. 19,tammikuu 2005( PMID 15640280 , DOI 10.1096 / fj.04-3180fje ).
- Yuste R, " Fluoresenssimikroskopia tänään ", Nature Methods , voi. 2, n o 12,joulukuu 2005, s. 902–4 ( PMID 16299474 , DOI 10.1038 / nmeth1205-902 ).
- Chudakov DM, Lukyanov S, Lukyanov KA, “ Fluorescent protein as a toolkit for in vivo imaging ”, Trends in Biotechnology , voi. 23, n o 12,joulukuu 2005, s. 605–13 ( PMID 16269193 , DOI 10.1016 / j.tibtech.2005.10.005 ).
- .
- Kouros-Mehr H, Bechis SK, Slorach EM, Littlepage LE, Egeblad M, Ewald AJ, Pai SY, Ho IC, Werb Z, " GATA-3 yhdistää kasvaimen erilaistumisen ja levittämisen luminaalisessa rintasyöpämallissa ", Cancer Cell , lento. 13, n ° 2Helmikuu 2008, s. 141–52 ( PMID 18242514 , PMCID 2262951 , DOI 10.1016 / j.ccr.2008.01.011 ).
- (sisään) J Voss-Andreae , " Protein Sculptures: Life's Building Blocks Inspire Art " , Leonardo , voi. 38,2005, s. 41–45 ( DOI 10.1162 / leon.2005.38.1.41 ).
- (in) Alexander Pawlak , " Inspirierende Protein " , Physik Journal , vol. 4,2005, s. 12.
- (in) " Julian Voss-Andreae Veistos " (näytetty 14 kesäkuu 2007 ) .
- Luonnon biotekniikka - 24, 1569-1571 (2006)
- Nature Biotechnology 24, 577-581 (2006).
- Nature Biotechnology 22, 1524-1525 (2004)