Naudan haiman ribonukleaasi
Naudan haiman ribonukleaasi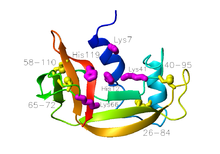 Naudan haiman ribonukleaasin rakenne. N -terminaalinen pää on sininen, kun taas C -terminaaliset pää on punainen; sivuketjut neljän jäämien ja kysteiinin sitoo disulfidisiltoja on esitetty keltainen, kun taas tähteet tärkeitä katalyysin on esitetty magenta ( ATE 7RSA )
Naudan haiman ribonukleaasin rakenne. N -terminaalinen pää on sininen, kun taas C -terminaaliset pää on punainen; sivuketjut neljän jäämien ja kysteiinin sitoo disulfidisiltoja on esitetty keltainen, kun taas tähteet tärkeitä katalyysin on esitetty magenta ( ATE 7RSA )
| EY-nro | EY |
|---|---|
| CAS-numero |
| IUBMB | IUBMB-merkintä |
|---|---|
| IntEnz | IntEnz-näkymä |
| BRENDA | BRENDA-sisäänkäynti |
| KEGG | KEGG-tulo |
| MetaCyc | Aineenvaihduntareitti |
| PRIAM | Profiili |
| ATE | Rakenteet |
| MENNÄ | AmiGO / EGO |
Naudan haiman ribonukleaasi , tai ribonukleaasi A: on haiman ribonukleaasi peräisin lajista Bos taurus . Tämä entsyymi , endonukleaasia että pilkkoo RNA kerrattu , on yksi aiheista Classical Studies in Science proteiineja . Se on tehty kaksi Nobel kemian : vuonna 1972 Christian Boehmer Anfinsen työstään proteiinilaskostumisen sekä Stanfordin Moore ja William Howard Stein heidän työstään kolmiulotteinen rakenne proteiinien ja niiden reaktiomekanismiin ; vuonna 1984 Robert Bruce Merrifieldille kemiallisen proteiinisynteesin kehittämisestä .
Naudan haiman ribonukleaasi pilkkoo RNA: n nukleotidien jälkeen pyrimidiiniksi mekanismina kahdessa tallin haiman ribonukleaasissa. Se voidaan inhiboida mukaan ribonukleaasin inhibiittoria , että ionit raskasmetallien, tai kompleksi uridiini - vanadaattia .
Rakenne ja ominaisuudet
Ribonukleaasi A on proteiini on suhteellisen pieni koko, joka käsittää 124 tähdettä on aminohapon , joka massa on noin 13,7 kDa . Sen voidaan kuvata koostuvan kahdesta kerroksesta a ja p, joilla on syvä rako sitoutumassa RNA: han . Ensimmäinen kerros koostuu kolmesta a-heliksistä (tähteet 3-14, 24-34 ja 50-60) proteiinin N- terminaalisella puolella . Toinen kerros koostuu kolmesta p-hiusneulasta (tähteet 61-74, 79-104 ja 105-124 C- pään puolella ), jotka muodostavat kaksi p-arkkia . Muodostunut hiusneulat tähteiden 61-74 ja 105-124 muodostavat levyn P nelisäikeinen antiparallel perustuu potkurin n o 3 (joka käsittää tähteet 50-60). Hiusneula β enää vuorovaikutuksessa lyhyen juosteen β muodostettu 42-45 tähdettä, jolloin saatiin levy β kolme antiparallel säikeitä, joka perustuu potkurin n o 2 (muodostettu tähteet 24-34).
Sen luontaisessa tilassa on neljä disulfidisidosten välissä tähteiden ja kysteiinin 26 ja 84 , 58 ja 110 , 40 ja 95 , ja 65 ja 72 . Kaksi ensimmäistä ovat välttämättömiä proteiinin taittumiselle liittämällä ensimmäisen kerroksen a-kierukka toisen kerroksen p-levyyn muodostaen pienen hydrofobisen ytimen naapuriinsa. Kaksi jälkimmäistä eivät sitä vastoin ole välttämättömiä, ja niitä voidaan joko vähentää (mutta ei molempia) vaikuttamalla proteiinin natiiviin tilaan fysiologisissa olosuhteissa. Nämä disulfidisillat yhdistävät silmukoita muodostavat segmentit ja ovat suhteellisen alttiita liuottimelle. Viimeisellä neljästä disulfidisillasta on erittäin vahva luonnollinen taipumus muodostaa, paljon suurempi kuin sen silmukan entropia (en) ehdottaisi , sekä peptidinä että kokonaisproteiinina. Tämä pyrkii viittaamaan siihen, että tähteistä 61-74 muodostuvalla P-hiusneulalla on voimakas luonnollinen taipumus muodostua proteiinin yleisen laskostumisen aikana.
Se on emäksinen proteiini , jonka isoelektrinen piste on pl = 9,63 . Sen monet positiiviset sähkövaraukset ovat yhdenmukaisia sen kanssa, että se sitoutuu RNA: han , joka on polyanioni . Yleisemmin sanottuna sitä on epätavallisen vähän ei-polaarisissa tähteissä , erityisesti alifaattisissa sivuketjuissa . Tämä voisi selittää, miksi se tarvitsee vähintään neljä disulfidisillaa kolmiulotteisen rakenteensa vakauttamiseksi. Hydrofobisten tähteiden puute voisi olla hyödyllinen myös vähentämällä sähköstaattista hylkivyyttä voimakkaasti sähköisesti varautuneissa ryhmissään ja matalan läpäisevyyden alueita, jotka ovat polaarittomia tähteitä.
Α N -terminaalisen heliksin , joka muodostuu tähteistä 3-13, on kytketty muuhun proteiinin joustavan laajentimen muodostettu tähteistä 16-23. Välikerroksen voidaan lohkaista mukaan subtilisiinin tähteiden n o 20 ja n o 21 ilman, että tämä potkuri irtoaa muusta entsyymin . Tuloksena olevaa proteiinikompleksia kutsutaan ribonukleaasiksi S ; tähteiden 1-20 muodostama peptidi on S-peptidi, kun taas loput tähteistä 21-124 muodostunut proteiini on S-proteiini . Dissosiaatiovakio S peptidin päässä S-proteiinia on noin 30 x 10 -12 mol L -1 : tämä voimakas affiniteetti voidaan hyödyntää proteiinipuhdistuksen menetelmiä sitomalla S peptidi on tutkittu proteiinin ja kierrättämällä kokoonpanon kautta affiniteettikromatografia laite .
Historia
Naudan haiman ribonukleaasista on tullut yleinen molekyylibiologian tutkimuskohde pääasiassa siksi, että se on erittäin stabiili ja se voidaan puhdistaa suurina määrinä jopa vanhimmilla proteiinipuhdistustekniikoilla . Panssari ja yritys pystyivät siten puhdistamaan kilogramman ribonukleaasia A vuonna 1940, mikä edustaa suurta määrää entsyymejä, erityisesti tuolloin, ja mahdollisti näytteiden saamisen ribonukleaasista alhaisin kustannuksin. Sen nimi ribonukleaasi A tulee nimenomaan sen suuresta runsaudesta markkinoilla ja johtavasta roolista ensimmäisten ribonukleaasien tutkimuksessa.
Tutkimukset Christian Anfinsen oksidatiivisen kääntyvät naudan haiman ribonukleaasi luoneet perustan ymmärtää suhdetta sekvenssi on aminohapot ja proteiini taittuvat osaksi kolmiulotteinen rakenne tiedot, ja vakiinnuttaneet termodynaamisen hypoteesi (in) , jonka mukaan proteiini omaksuu kolmiulotteisen konformaation, joka minimoi sen vapaan energian .
Ribonukleaasi A on myös ensimmäinen entsyymi, jolle on ehdotettu oikeaa reaktiomekanismia , ennen kuin sen rakenne on selvitetty. Se on myös ensimmäinen proteiini osoittaa vaikutusta isomerointiin ole natiivi peptidisidosten ennen tähteet on proliini aikana kääntyvät .
Naudan haiman ribonukleaasi oli myös ensimmäinen proteiinimalli, jota tutkittiin tekniikoilla, kuten absorbanssi , pyöreä dikroismi , Raman-spektroskopia , elektronin paramagneettinen resonanssi ja ydinmagneettinen resonanssi , tai tutkimuksen kohteeksi. Kemialliset tutkimusmenetelmät, kuten paljaiden sivuketjujen kemiallinen muokkaus , antigeenien tunnistaminen ja häiriintyneiden segmenttien rajoitettu proteolyysi . Ribonukleaasi S saatu käsittelemällä ribonukleaasi A: mukaan subtilisiini , oli kolmas proteiini, jonka kolmiulotteinen rakenne on ratkaistu kristallografia 1967.
Huomautuksia ja viitteitä
- (in) Alexander Wlodawer L. Anders Svensson, Lennart Sjoelin ja Gary L. Gilliland , " rakenne fosfaatittomia ribonukleaasi A: tarkennettu 1,26 Å " , Biochemistry , voi. 27, n o 8, 19. huhtikuuta 1968, s. 2705-2717 ( PMID 3401445 , DOI 10.1021 / bi00408a010 , lue verkossa )
- (in) Ronald T. Raines , " Ribonukleaasin " , Chemical Reviews , Vol. 98, n ° 3, 7. toukokuuta 1998, s. 1045-1066 ( PMID 11848924 , DOI 10.1021 / cr960427h , lue verkossa )
-
(in) " Nobelin kemian vuonna 1972 " (saatavissa myös 4 päivänä heinäkuuta 2015 mennessä ) :
"Kemian Nobel-palkinto 1972 jaettiin, toinen puoli myönnettiin Christian B.Anfinsenille" ribonukleaasia koskevasta työstään, erityisesti aminohapposekvenssin ja biologisesti aktiivisen konformaation välisestä yhteydestä ", toinen puoli yhdessä Stanford Mooren ja Williamin kanssa H. Stein " osallistumisestaan ribonukleaasimolekyylin aktiivisen keskuksen kemiallisen rakenteen ja katalyyttisen aktiivisuuden välisen yhteyden ymmärtämiseen ". "
-
(vuonna) " Kemian Nobel-palkinto vuonna 1984 " (katsottu 4. heinäkuuta 2015 ) :
"Kemian Nobel-palkinto 1984 myönnettiin Bruce Merrifieldille" kemiallisen synteesin metodologian kehittämisestä kiinteällä matriisilla ". "
- (in) " Ribonukleiinihappojen rakenteesta. II. Ribonukleaasitoiminnan tuotteet ” , Journal of Biological Chemistry , voi. 205, n ° 2 Joulukuu 1953, s. 767-782 ( PMID 13129256 , lue verkossa )
- (en) FM Richards , ” Vuoden 1972 kemian Nobel-palkinto ” , Science , voi. 178, n o 4060 3. marraskuuta 1972, s. 492-493 ( DOI 10.1126 / science.178.4060.492 , lue verkossa )
- (in) Garland R. Marshall, Feng Jiawen A. Daniel J. Kuster , " Paluu tulevaisuuteen: Ribonukleaasin " , Peptide Science , vol. 90, n ° 3, 2008, s. 259-277 ( PMID 17868092 , DOI 10.1002 / bip.20845 , lue verkossa )
- (in) Claudi M. Cuchillo M. Victòria Nogués ja Ronald T. Raines , " Naudan haiman ribonukleaasi: viisikymmentä vuotta ensimmäistä entsymaattista reaktiomekanismia " , Biochemistry , voi. 50, n ° 37, 20. syyskuuta 2011, s. 7835-7841 ( PMID 21838247 , PMCID 3172371 , DOI 10.1021 / bi201075b , lue verkossa )
- (in) Franz X. Schmid ja Robert L. Baldwin , " Hitaasti laskostuvien RNaasi A -lajien muodostumisen happokatalyysi: Evidence que la proliinin isomerointireaktio on " , Proceedings of the National Academy of Sciences of the United States of America , voi. 75, n ° 10, 1. st lokakuu 1978, s. 4764-4768 ( PMID 283390 , PMCID 336200 , DOI 10.1073 / pnas.75.10.4764 , lue verkossa )
- (sisään) HW Wyckoff, Karl D. Hardman, NM Allewell, Tadashi Inagami, LN Johnson ja Fred Richards , " Ribonukleaasi-S: n rakenne 3,5 A: n resoluutiolla " , Journal of Biological Chemistry , voi. 242, n ° 17, 10. syyskuuta 1967, s. 3984-3988 ( PMID 6037556 , lue verkossa )