Metaanihappo
| metaanihappo | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Lewis ja 3D-kaavat metaanihapolle | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Henkilöllisyystodistus | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| IUPAC-nimi | Metaanihappo | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Synonyymit |
muurahaishappo |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o CAS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o ECHA | 100 000 527 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N O EY | 200-579-1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| PubChem | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| N o E | E236 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| FEMA | 2487 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Hymyilee |
C (= O) O , |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| InChI |
InChI: InChI = 1 / CH2O2 / c2-1-3 / h1H, (H, 2,3) / f / h2H |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ulkomuoto | väritön neste, savuinen, pistävä haju | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kemialliset ominaisuudet | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Raaka kaava |
C H 2 O 2 [Isomeerit] |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Moolimassa | 46,0254 ± 0,0015 g / mol C 26,1%, H 4,38%, O 69,52%, |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| pKa | 3,751 ( 25 ° C ) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dipolaarinen hetki | 1,425 ± 0,002 D | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molekyylihalkaisija | 0,381 nm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fyysiset ominaisuudet | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T ° fuusio | 8,3 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| T ° kiehuu | 101 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Liukoisuus |
1000 g · l -1 (vesi, 25 ° C ), sekoittuu etanolin , asetonilla ja eetterillä |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Liukoisuusparametri δ |
24,8 MPa 1/2 ( 25 ° C ); 21,4 J 1/2 · cm -3/2 ( 25 ° C ) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
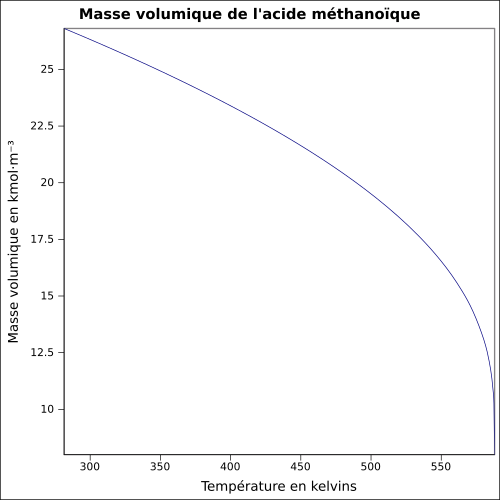
| Tilavuusmassa | 1,22 25 ° C: ssa
yhtälö:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Itsesyttymislämpötila lämpötilan | 520 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Leimahduspiste | 69 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Räjähdysrajat ilmassa | 14 - 34 til-% | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kyllästävä höyrynpaine |
42,6 mmHg ( 25 ° C )
yhtälö:

|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dynaaminen viskositeetti | 1,57 x 10 -3 Pa s ajan 26 ° C: ssa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kriittinen piste | 306,85 ° C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kolmoispiste | 281,45 K ( 8,3 ° C ) 23,6 mbar |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Lämpökemia | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| S 0- kaasu, 1 bar | 248,7 J mol −1 K −1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| S 0 neste, 1 bar | 131,8 J mol −1 K −1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| A f H 0 -kaasu | −378,6 kJ mol −1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Δ f H 0 neste | −425,1 kJ mol −1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| C s |
45,7 J · mol -1 · K -1 (höyry) 99,0 J · mol -1 · K -1 (neste) yhtälö:
yhtälö:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| PCS | 254,6 kJ · mol -1 ( 25 ° C , neste) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sähköiset ominaisuudet | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1 re ionisaatioenergia | 11,33 ± 0,01 eV (kaasu) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Optiset ominaisuudet | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Taitekerroin | 1.3694 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Varotoimenpiteet | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SGH | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
   Vaara H226, H302, H314, H331, H226 : Syttyvä neste ja höyry H302 : Haitallista nieltynä H314 : Voimakkaasti ihoa syövyttävää ja silmiä vaurioittavaa H331 : Myrkyllistä hengitettynä |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| WHMIS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
  B3, E, B3 : Palavan nesteen leimahduspiste = 46,5 ° C suljettu kuppi (menetelmää ei raportoitu) E : Syövyttävä materiaali Vaarallisten aineiden kuljetus: luokka 8 Ilmoitus 1,0% ainesosaluettelon mukaan |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NFPA 704 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2 3 0 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kuljetus | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
1779 : MUOTOLAISHAPPO |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Hengitys | Väkevöidyt höyryt ovat syövyttäviä | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nieleminen | Myrkyllinen, voi aiheuttaa allergisia reaktioita. Epäillään mutageenista ainetta | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ekotoksikologia | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| DL 50 |
700 mg · kg -1 (hiiri, oraalinen ) 145 mg · kg -1 (hiiret, iv ) 940 mg · kg -1 (hiiret, ip ) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| LogP | -0,54 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Hajukynnys | matala: 1,6 ppm korkea: 340 ppm |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SI- ja STP- yksiköt, ellei toisin mainita. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Metaanihappo (tunnetaan myös muurahaishappoa ) on yksinkertaisin karboksyylihapot . Sen kemiallinen kaava on C H 2 O 2 tai HCOOH. Sen konjugaattiemäs on metanoaatti- ioni (formiaatti), jolla on kaava HCOO - . Se on heikko happo, joka tulee värittömän nesteen muodossa, jolla on tunkeutuva haju.
Luonnossa sitä esiintyy useiden Hymenoptera-lajien hyönteisten , kuten mehiläisten ja muurahaisten , rauhasissa , mutta myös karvoissa, jotka muodostavat tiettyjen urticaceae- perheen kasvien ( nokkoset ) lehdet . Sen triviaalinen muodollinen nimi on peräisin latinankielisestä sanasta formica, joka tarkoittaa muurahaisia, koska se eristettiin ensimmäistä kertaa tislaamalla muurahaisia.
Historia
Alkaen XV th luvulla, jotkut alkemisteja ja naturalists olivat tietoisia siitä, että jotkut muurahaisia , erityisesti laji Formica , tuottaa höyryä happo . Ensimmäinen henkilö, joka on kuvannut tämän aineen eristämisen ( tislaamalla suuren määrän muurahaisruumoja), on englantilainen luonnontieteilijä John Ray vuonna 1671. Hänen ensimmäinen synteesinsä teki ranskalainen kemisti Gay-Lussac l ' syaanivetyhaposta . Vuonna 1855 toinen ranskalainen kemisti Marcellin Berthelot kehitti synteesimenetelmän hiilimonoksidista , samanlainen kuin nykyään. Muurahaishappoa on läsnä suurimman osan muurahaismyrkkyistä, jotka suihkuttavat tai levittävät sitä suoraan muiden niveljalkaisten kynsinauhojen lävistämiseen tai mahdollisten saalistajien karkottamiseen .
Kemia
Vähentävät ominaisuudet
Rikkihapolla lämmitetty muurahaishappo hajoaa vedeksi ja hiilimonoksidiksi siten, että sillä on erittäin merkittävät pelkistävät ominaisuudet ( kulta- , hopea- , kuparisuolojen pelkistys jne.). Alle lämmön vaikutuksesta yksin, se hajoaa noin 160 ° C: ssa otetaan vetyä ja hiilidioksidia , mikä johtaa jälleen vähentää ominaisuuksia.
Heikko happo
Vaikka se on ionisoituneempi kuin korkeamman karboksyylihapon vastineet, se on heikko happo , mutta siitä huolimatta se pystyy syrjäyttämään typpihapon suoloistaan. Jos muurahaishappoa lisätään kaliumnitraatin ja brusiinin seokseen, seos muuttuu välittömästi punaiseksi. Se ei anna happoanhydridiä ja antaa kuten asyylihalidia yhtä fosgeeni COCI 2 .
Valmistus
Kuumentamalla potaskaa ja hiilimonoksidia suljetussa putkessa Berthelot syntetisoi muurahaishappoa: CO + KOH → H-CO 2 K, sitten 7 atm: n paineessa. ja 170 ° C: ssa , hydrolyysi kaliumia formaatin H - CO 2 K rikkihapolla ; tuote, joka saadaan tislaamalla alipaineessa, sisältää 80 - 85% muurahaishappoa.
Käyttää
Metaanihappo käytetään seuraavassa teollisuuden: tekstiilit ( väriaineet , nahka hoito ), hyönteisten torjunta-aineet , lakat , liuottimet , rusketuksen , elektrolyyttistä, savutusaineet , ihmisravinnoksi ( elintarvikelisäaineen E236). Sitä käytetään myös hopeaa peilit ja hoitoon syyliä.
Sitä käytetään myös mehiläishoidossa täydentävänä keinona varroan torjumiseksi . Sitä käytetään myös kalkinpoistoaineissa (wc-geeli).
Biologinen merkkiaine
Aikana metanolia myrkytys , jälkimmäinen metaboloituu ensin metanaali vaikutuksesta alkoholidehydrogenaasi , ei-spesifisellä entsyymillä, jolla on parempi affiniteetti etanolilla , sitten muurahaishappoa toiminnan välityksellä formaldehydidehydrogenaasin . Viimeinen vaihe koostuu muutoksesta hiilidioksidiksi , vaihe, joka rajoittaa eliminaatiota. Kun metanaali muuttuu nopeasti, muodostuu formiaatin kertymistä ja se on myrkyllisyyden ( metabolisen asidoosin ) syy . Formiaattien mittaus virtsasta voi havaita metanolimyrkytyksen.
Tutkimus Leibniz Institute for Catalysis Rostock on osoittanut, että sitä voidaan käyttää varastointiin vedyn valtaan polttokenno .
Platinan läsnä ollessa on mahdollista hajottaa muurahaishappo vedyksi ja hiilidioksidiksi .
CH 2 O 2 → H 2 + CO 2Vuonna 2006 tutkimusryhmä EPFL: stä (Sveitsi) esitteli muurahaishapon käytön vedyn varastointiliuoksena . Saatiin homogeeninen katalyyttinen järjestelmä, joka perustuu vesiliuosta ruteniumkatalyytit hajoaa muurahaishappoa HCOOH osaksi divetyfosfaatti H 2 ja hiilidioksidia CO 2 . Divetyä voidaan siten tuottaa laajalla painealueella (1 - 600 bar ) eikä reaktio tuota hiilimonoksidia . Tämä katalyyttinen järjestelmä ratkaisee olemassa olevien katalyyttien ongelmat muurahaishapon hajoamisessa (alhainen stabiilisuus, rajoitettu katalysaattorin käyttöikä, hiilimonoksidin muodostuminen) ja tekee tämän vedyn varastointimenetelmän elinkelpoiseksi. Tämän hajoamisen sivutuotetta, hiilidioksidia, voidaan käyttää toisena vaiheena muurahaishapon muodostamiseksi uudelleen hydraamalla. Katalyyttisellä hydrauksella CO 2 on tutkittu laajasti ja tehokkaita menetelmiä on kehitetty.
Muurahaishappo sisältää 53 g · l -1 vetyä huoneenlämpötilassa ja paineessa, mikä on kaksi kertaa vetyä, joka on puristettu 350 baariin . Puhdas muurahaishappo on syttyvä neste , jonka leimahduspiste on + 69 ° C ja joka on korkeampi kuin bensiini ( −40 ° C ) tai etanoli (+ 13 ° C ). Laimennettuna 85 prosentista se ei ole enää syttyvää. Laimennettu muurahaishappo on jopa Food and Drug Administrationin (FDA) elintarvikelisäaineiden luettelossa.
Käydä kauppaa
Ranska on muurahaishapon nettotuoja ranskalaisten tapojen mukaan. Keskimääräinen tuontitonnihinta oli 600 euroa.
Tunnistus aurinkokunnan ulkopuolella
Vuonna 2018, metaanihappo havainnoitiin ALMA radio teleskooppi on protoplanetary levy tähti TW Hydrae .
Huomautuksia ja viitteitä
- FORMIC ACID, kemiallisten aineiden turvallisuuden kansainvälisen ohjelman käyttöturvallisuustiedote (t) , kuultu 9. toukokuuta 2009
- (en) " Metanoic acid " , ChemIDplus-sivustossa , käyty 8. helmikuuta 2009
- (in) David R. LiDE, Handbook of Chemistry and Physics , CRC,16. kesäkuuta 2008, 89 th ed. , 2736 Sivumäärä ( ISBN 142006679X ja 978-1420066791 ) , s. 9-50
- (en) Yitzhak Marcus, The Properties of Solvents , voi. 4, Englanti, John Wiley & Sons Ltd,1999, 239 Sivumäärä ( ISBN 0-471-98369-1 )
- laskettu molekyylimassa välillä " Atomic painot Elements 2007 " on www.chem.qmul.ac.uk .
- (in) James E. Mark, Physical Properties of Polymer Handbook , Springer,2007, 2 nd ed. , 1076 Sivumäärä ( ISBN 0387690026 , lue verkossa ) , s. 294
- (en) Robert H. Perry ja Donald W. Green , Perry's Chemical Engineers 'Handbook , USA, McGraw-Hill,1997, 7 th ed. , 2400 Sivumäärä ( ISBN 0-07-049841-5 ) , s. 2-50
- " Eri kaasujen ominaisuudet ", osoitteessa flexwareinc.com (käytetty 12. huhtikuuta 2010 )
- (in) Carl L. leuat, Handbook of termodynaamiset kaaviot , Voi. 1, 2 ja 3, Huston, Texas, Gulf Pub. Co,1996( ISBN 0-88415-857-8 , 978-0-88415-858-5 ja 978-0-88415-859-2 )
- (in) David R. LiDE , CRC Handbook of Chemistry and Physics , Boca Raton, CRC Press,18. kesäkuuta 2002, 83 th ed. , 2664 Sivumäärä ( ISBN 0849304830 , online-esitys ) , s. 5-89
- (in) David R. LiDE, Handbook of Chemistry and Physics , CRC,2008, 89 th ed. , 2736 Sivumäärä ( ISBN 978-1-4200-6679-1 ) , s. 10-205
- Sigma-Aldrichin julkaisema käyttöturvallisuustiedote, tarkasteltu 5. syyskuuta 2020
- " Muurahaishappo " kemiallisten tuotteiden tietokannassa Reptox of the CSST (Quebec-organisaatio, joka vastaa työturvallisuudesta ja työturvallisuudesta), käyty 24. huhtikuuta 2009
- " Muurahaishappo " osoitteessa hazmap.nlm.nih.gov (käytetty 14. marraskuuta 2009 )
- http://www.myrmecofourmis.fr/Jets-d-acide-formique-par-des-fourmis
- " Katso näiden muurahaisien myrkky puhaltaa kuplia!" » [Video] , YouTubessa (käytetty 12. syyskuuta 2020 ) .
- Codex Alimentarius, " Elintarvikelisäaineiden luokkien nimet ja kansainvälinen numerointijärjestelmä " , osoitteessa http://www.codexalimentarius.net ,2009(katsottu 19. toukokuuta 2010 )
- Mehiläishoitaja68, " Varroan käsittely muurahaishapolla " , osoitteessa http://same-apiculture.colinweb.fr/ ,18. joulukuuta 2010(käytetty 17. elokuuta 2017 )
- http://www.bulletins-electroniques.com/actualites/54627.htm
- Gábor Laurenczy, Céline Fellay, Paul J.Dyson, Vedyn tuotanto muurahaishaposta. PCT Int. Appl. (2008), 36 s. KOODI: PIXXD2 WO 2008047312 A1 20080424 AN 2008: 502691
- Céline Fellay, Paul J.Dyson, Gábor Laurenczy, elinkelpoinen vetyvarastointijärjestelmä, joka perustuu selektiiviseen muurahaishappohajoamiseen ruteniumikatalyytillä, Angew. Chem. Int. Toim. , 2008 , 47 , 3966–3970.
- Ferenc Joó, Läpimurtoja vedyn varastoinnissa - muurahaishappo vedyn kestävänä varastointimateriaalina, ChemSusChem 2008 , 1 , 805–808.
- PG Jessop, julkaisussa Handbook of Homogeneous Hydrogenation (Toim.: JG de Vries, CJ Elsevier), Wiley-VCH, Weinheim, Saksa, 2007 , s. 489–511 .
- PG Jessop, F.Jóó, C.-C. Tai, viimeaikainen kehitys hiilidioksidin homogeenisessa hydrauksessa, Coord. Chem. Ilm. , 2004 , 248, 2425–2442.
- Yhdysvaltain liittovaltion säännöstö: 21 CFR 186.1316, 21 CFR 172.515
- " Tuonti- ja vientikaupan indikaattori " , tullin pääosastossa. Ilmoita NC8 = 29151100 (käytetty 7. elokuuta 2015 )
- (en) Cécile Favre, Davide Fedele, Dmitry Semenov, Sergey Parfenov et ai. , " Yksinkertaisen orgaanisen hapon ensimmäinen havainto planeettalevyllä " , The Astrophysical Journal Letters ,16. heinäkuuta 2018( lue verkossa ).